Gruppe Geisberger
Onkogenomik und Tumor-Immun-Interaktionen

Forschungsüberblick
Die DNA unserer Zellen wird ständig beschädigt, wie zB durch Strahlung, reaktive Stoffwechselprodukte oder durch Fehler während der DNA-Verdopplung. Eine ungenaue Reparatur dieser DNA-Schäden kann zu Mutationen, chromosomalen Veränderungen und Verlust genetischer Information führen, die Krankheiten, einschließlich Krebs, zur Folge haben können. Darüber hinaus fördert eine fehlerhafte DNA-Reparatur die genetische Heterogenität von Krebszellen, wodurch es zum Auswachsen von therapieresistenten Krebszellen kommen kann, was ein großes klinisches Problem darstellt.
In unserer Forschungsgruppe untersuchen wir wie DNA-Reparaturwege in Krebszellen verändert werden und wir suchen nach Möglichkeiten, wie diese Veränderungen für bessere Behandlungsansätze nutzbar gemacht werden können, ins besonders in Hinblick auf eine effiziente Krebsabwehr durch das körpereigene Immunsystem. Unser Ziel ist es alle molekularen, zellulären und immunologischen Aspekte unserer Forschungsthematik in einem möglichst breiten Kontext zu verstehen. Dabei verwenden wir unterschiedlichste molekulare und biochemische Methoden und Modellsysteme, darunter Zelllinien, Mausmodelle und primäre humane Krebsproben mit einem besonderen Schwerpunkt auf der chronisch lymphatische Leukämie.
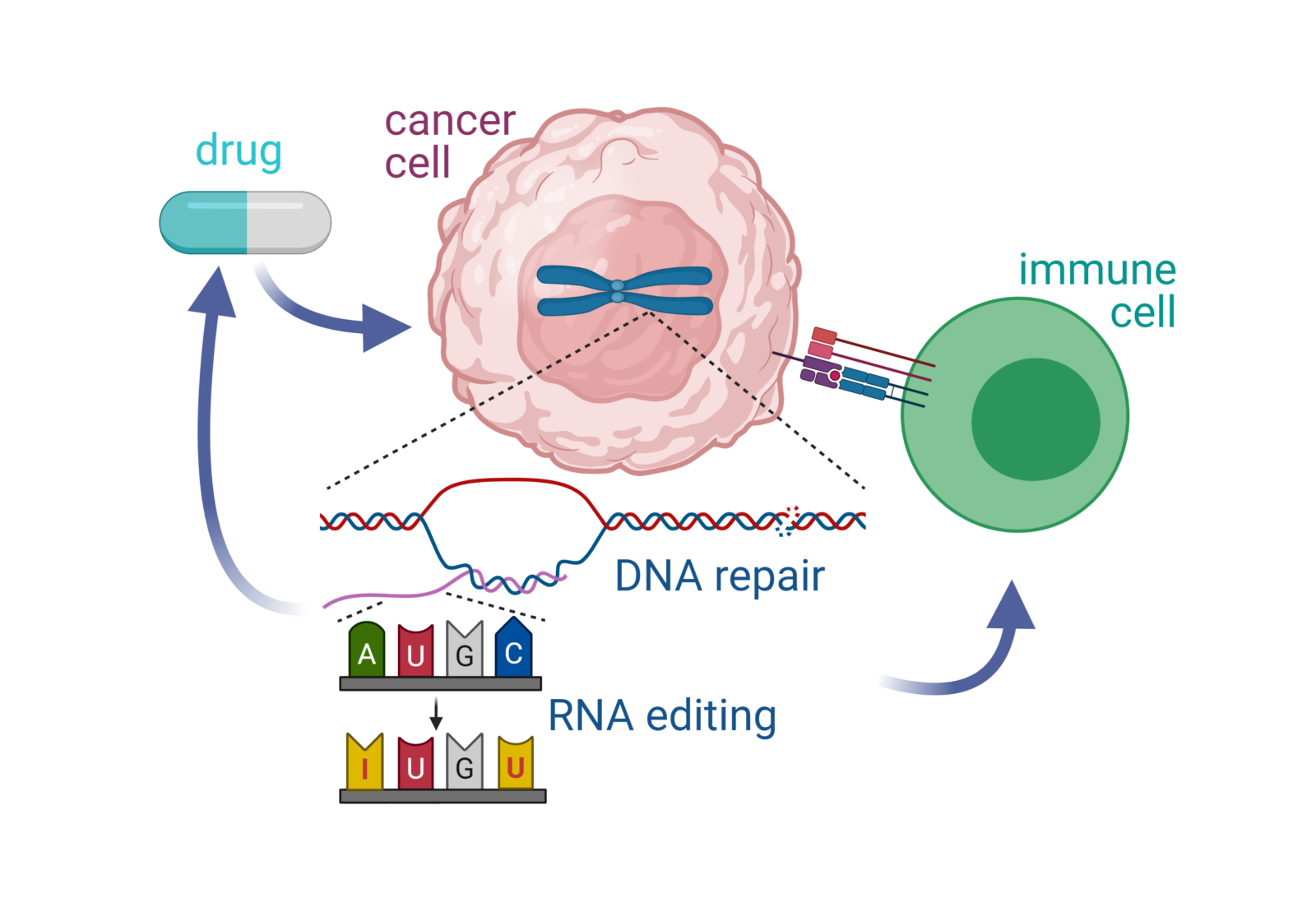
Reparatur von DNA Schäden in Krebszellen
Jede Veränderung der genetischen Information einer Zelle kann zu einer abweichenden Genexpression oder Genaktivität und damit zu Krankheiten, einschließlich Krebs, führen. Nahezu jede Krebszelle weist genetische Veränderungen auf, die durch unpräzise DNA-Reparatur erworben wurden. Krebszellen nutzen häufig ungenaue oder fehlgeleitete Reparaturwege, um eine genetische Variabiliät zu fördern, aus der sich „fittere“ oder (immun)therapieresistente Krebszellen durchsetzen können, ein Prozess der als klonale Evolution bezeichnet wird. In diesem Forschungsschwerpunkt wollen wir Mechanismen untersuchen, die für die Diversifizierung der genetischen Information während der klonalen Krebsevolution verantwortlich sind. Dadurch sollen Möglichkeiten gefunden werden, wie eine Anpassung der Krebszellen auf Medikamente verhindert werden kann und wie Krebs-spezifische Reparaturwege als Ansatzpunkt für zielgerichtete Krebstherapien benutzt werden können.
Tumor-Immun-Interaktionen
Während des Krebswachstums müssen die Krebszellen ständig einem Angriff des Immunsystems standhalten. Diese ständige Interaktion zwischen Krebs und Immunsystem verändert sowohl die Krebszellen als auch die Immunzellen in einer Weise, die zu einer Dysfunktion des Immunsystems und immunologisch „unsichtbaren“ Tumorzellen führt. In unserer Forschung wollen wir Tumor-Immun-Interaktionen und die damit verbundenen Veränderungen auf Seiten des Immunsystems sowie des Tumors von frühen bis späten Zeitpunkten einer Krebserkrankung untersuchen, um zu verstehen wie das Immunsystem von den Krebszellen stillgelegt wird. Im Besonderen wollen wir verstehen, wie sich Angriffe des Immunsystems auf genetische Veränderungen in den Krebszellen auswirken und wie diese wiederum auf Immunzellen rückwirken. Diese Untersuchungen sollen letztendlich darauf abzielen Wege zu finden um körpereigene Immunzellen, vor allem T Lymphozyten zu aktivieren und damit eine dauerhafte und effiziente Bekämpfung der Krebszellen zu ermöglichen.

Team
Roland Geisberger
Group leader
orcid ID: 0000-0002-0131-2191
Ekaterina Akimova
PostDoc
Philine Hoven
PhD student
Dominik Baumgartner
PhD student
Julia Moser
Master Student
Fiona Liebig
Master Student

Publikationen
Akimova E, Gassner FJ, Schubert M, Rebhandl S, Arzt C, Rauscher S, Tober V, Zaborsky N, Greil R, Geisberger R. SAMHD1 restrains aberrant nucleotide insertions at repair junctions generated by DNA end joining. Nucleic Acids Res. 2021 Mar 18;49(5):2598-2608. doi: 10.1093/nar/gkab051.
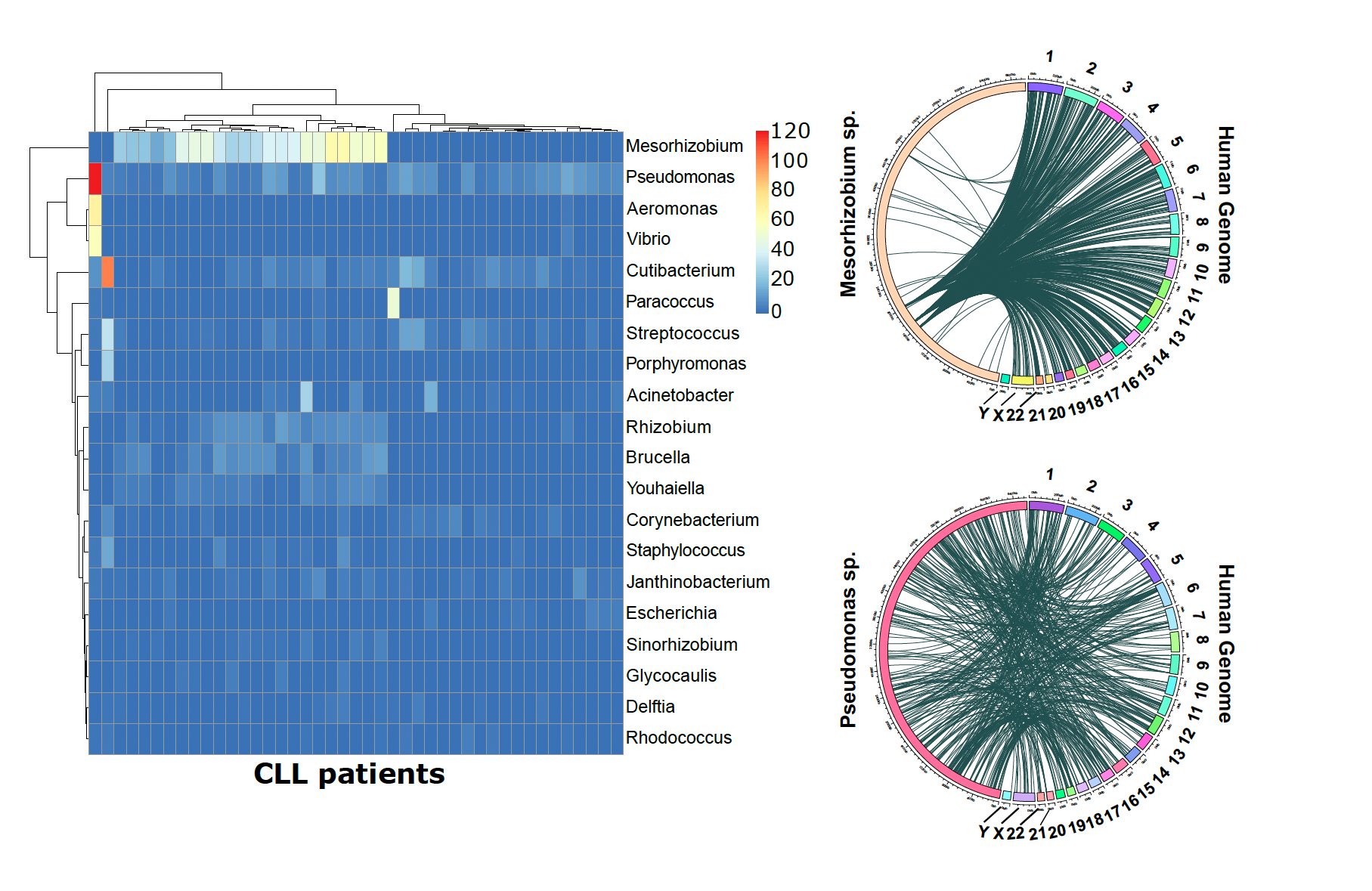
Gassner FJ, Zaborsky N, Buchumenski I, Levanon EY, Gatterbauer M, Schubert M, Rauscher S, Hebenstreit D, Nadeu F, Campo E, Egle A, Greil R, Geisberger R. RNA editing contributes to epitranscriptome diversity in chronic lymphocytic leukemia. Leukemia. 2021 Apr;35(4):1053-1063. doi: 10.1038/s41375-020-0995-6. Epub 2020 Jul 30.
Catakovic K, Gassner FJ, Ratswohl C, Zaborsky N, Rebhandl S, Schubert M, Steiner M, Gutjahr JC, Pleyer L, Egle A, Hartmann TN, Greil R, Geisberger R. TIGIT expressing CD4+T cells represent a tumor-supportive T cell subset in chronic lymphocytic leukemia. Oncoimmunology. 2017 Sep 21;7(1):e1371399. doi: 10.1080/2162402X.2017.1371399.
Gassner FJ, Schubert M, Rebhandl S, Spandl K, Zaborsky N, Catakovic K, Blaimer S, Hebenstreit D, Greil R, Geisberger R. Imprecision and DNA Break Repair Biased towards Incompatible End Joining in Leukemia. Mol Cancer Res. 2018 Mar;16(3):428-438. doi: 10.1158/1541-7786.MCR-17-0373. Epub 2017 Dec 8.
Sie haben ein Anliegen oder Fragen?
Nehmen Sie mit uns Kontakt auf – wir melden uns umgehend bei Ihnen zurück.

