Gruppe Egle
Immun-Interaktionen und Signalwege in humaner und muriner CLL

Konzepte/Grundlagen
Tumorbiologie ist ein komplexes Zusammenspiel von Veränderungen der Zellen, welche die klonale Evolution eines sich selbst reproduzierenden Organismus ermöglichen und sich nicht an die globalen Ziele des Organismus anpassen. Neben Veränderungen im genetischen Profil durch Mutation oder epigenetische Dysregulation, gibt es zahlreiche zelluläre Interaktionen (z. B. mit der Nischenumgebung, dem Immunsystem etc.) und programmierten Restriktionen (z. B. Zellstadien-spezifische Expressions- und Signalsysteme sowie Identitäten), durch deren Evolution die Entstehung eines sich selbst reproduzierenden Tumors ermöglicht wird (Abbildung 1).
Die chronische lymphatische Leukämie (CLL) ist nicht nur eine äußerst relevante und belastende Erkrankung für unsere Patienten in der Klinik, sondern auch ein einzigartiges Modell zur Untersuchung der oben beschriebenen komplexen Wechselwirkungen. Sie weist eine komplexe und heterogene genetische Landschaft, definierte Interaktionen mit dem Mikromilieu und dem Immunsystem sowie spezifische Bindungen auf der Entwicklungsebene der Tumorzellen auf. Diese verschiedenen Facetten der Erkrankung können untersucht werden, um die Tumorbiologie besser zu verstehen und somit für therapeutische Konzepte nutzbar zu machen.
Lösung
Die Arbeitsgruppe Egle ist mit der komplexen Aufgabe konfrontiert, zelluläre Signalübertragung und zelluläres Verhalten im Kontext zahlreicher relevanter Zell-Zell-Interaktionen zu modellieren, und verfolgt dabei einen Ansatz, der den klinischen Zugang zu validierten klinischen Primärproben von Patienten in Kombination mit modernsten Profilierungstechnologien und komplexen Kulturansätzen nutzt. Darüber hinaus konzentriert sich die Arbeitsgruppe zum einen auf die Entwicklung und
schrittweise Validierung geeigneter Mausmodelle für spezifische Fragestellungen, um klare „Proof-of-Principle“-Experimente zu ermöglichen. Auf diese Weise konnten wir auf der Grundlage von Experimenten mit sowohl primären Patientenproben, wie auch Mausmodellen, eine Reihe wichtiger Mechanismen erforschen und validieren, die für die Pathogenese von CLL eine entscheidende Rolle spielen.
Fortschritte/Forschungsergebnisse
In den vergangenen über 15 Jahren hat die Arbeitsgruppe Egle Mausmodelle für CLL entwickelt und dabei hochentwickelte genetische und experimentelle Instrumente eingesetzt, um neue wissenschaftliche Erkenntnisse in einer Vielzahl von Bereichen zu gewinnen:
- Definition von wesentlichen Signalkomponenten, die bei der Entstehung und Aufrechterhaltung der CLL, beteiligt sind, u.a. mit ersten „Proof-of-Principle-Experimenten“, in denen die Signalkomponenten im BCR Signalweg als valide therapeutische Targets definiert wurden,1 eine Strategie die sich derzeit in klinischer Weiterentwicklung von Medikamenten für diesen Signalweg befindet.
- Definition von wesentlichen Interaktionen zwischen dem Mikromilieu und Tumorzellen2, insbesondere im Hinblick auf therapeutisch relevante Zielstrukturen.3
- Definition von Immuninteraktionen und von sogenannten Immune Evasion Strategien (ein Mechanismus bei dem Tumorzellen den Angriffen des Immunsystems entgehen), die die Entwicklung der CLL vorantreiben oder einschränken.4,5
- Definition von Signalweg Signaturen, die unabhängig von mutationsbedingten Veränderungen in einem Signalweg mit dem klinischen Erscheinungsbild der CLL assoziiert sind und welche die Tumorbiologie mit Hilfe von Signalwegmuster beschreiben.6
- Definition von molekularen Veränderungen in der Biologie von muriner CLL durch Hochdurchsatz-Sequenzierung.7
Vorhaben
Basierend auf langjährigen Erfahrungen und ausgestattet mit einem wachsenden Arsenal an technischen Hilfsmitteln und genetischen Ressourcen (sowohl bei humaner, wie auch muriner CLL) sind wir nun in eine konzeptionelle „Proof-of-Principle-Phase“ eingetreten, in der wir wiederkehrende und zusammenwirkende Signalwegmuster von CLL bestimmen, und als sogenannte „Signalotypen“ beschreiben können.
Forschungsschwerpunkt
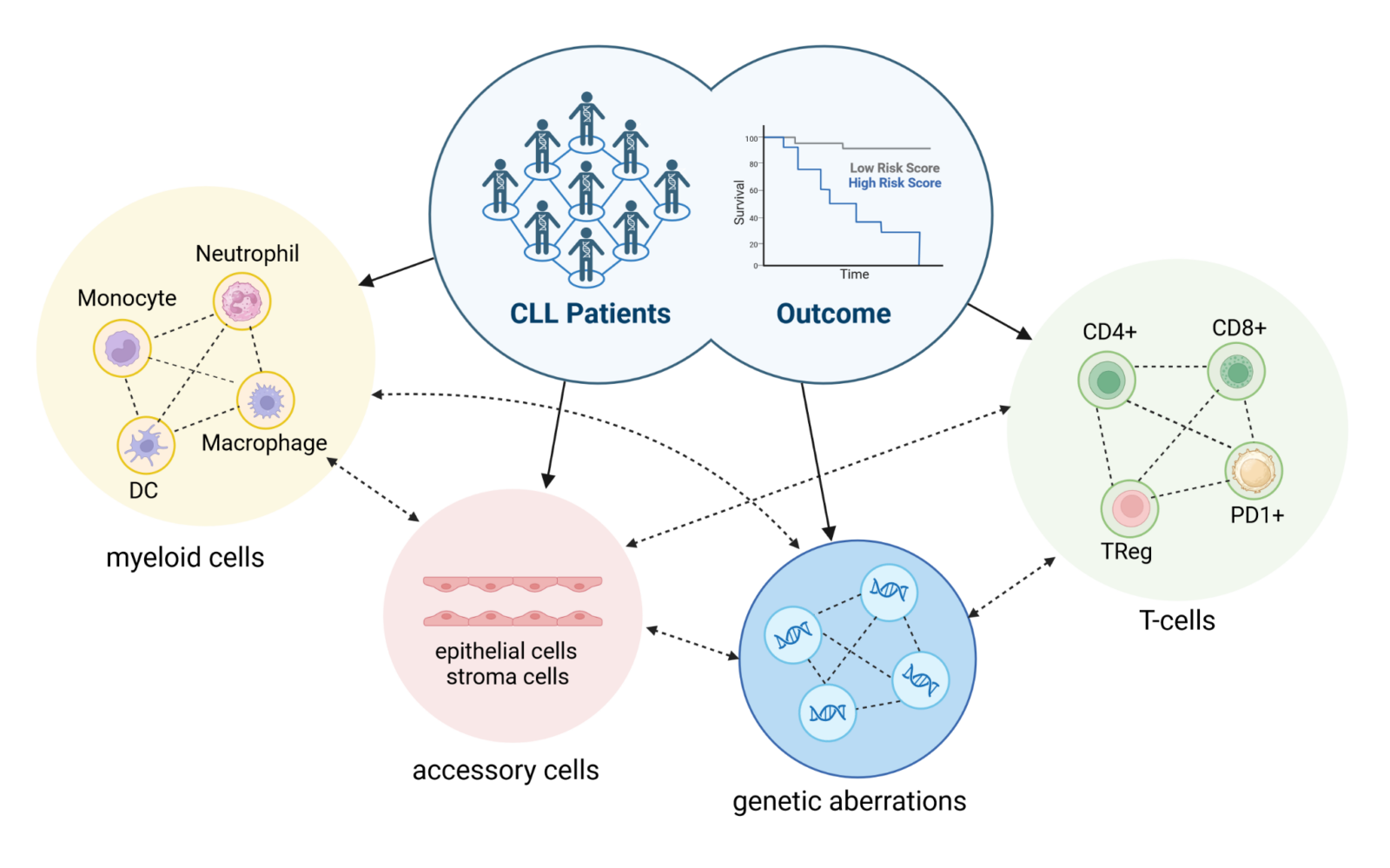
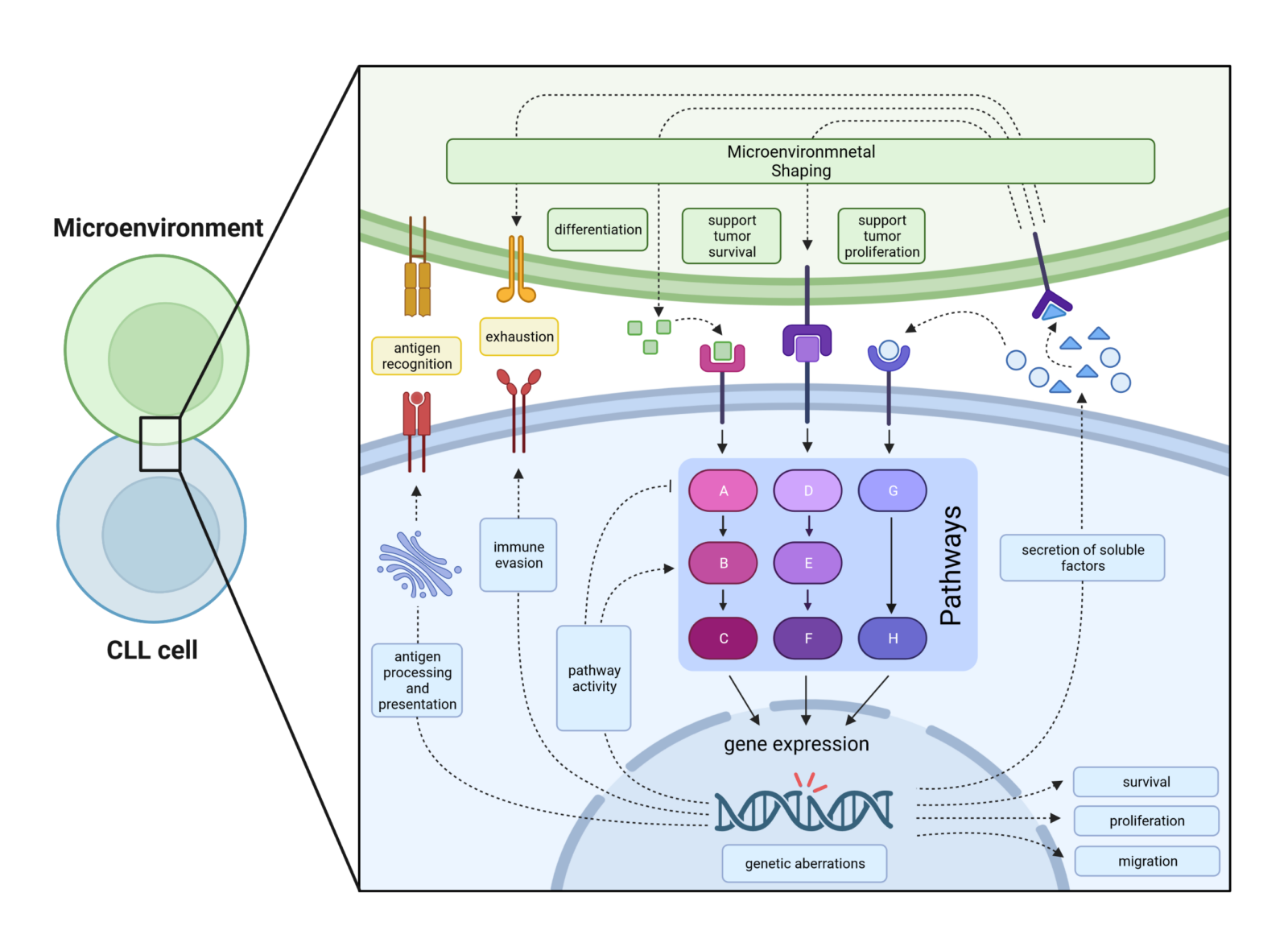
Chronische lymphatische Leukämie ist eine klinisch und biologisch äußerst komplexe und heterogene Erkrankung, welche von chromosomalen Aberrationen, Mutationen in verschiedenen Genen, dem Einfluss des Mikromilieus2,8 und Interaktionen mit Immunzellen geprägt ist. Die Wechselwirkung dieser Faktoren wirkt sich letztlich stark auf den Krankheitsverlauf und den Behandlungserfolg aus (Abbildung 1).1,9,10 Bei CLL Patienten wird die Heterogenität der Erkrankung in der Regel anhand klassischer prognostischer Faktoren, genetischer Aberrationen und der prozentualen Verteilung von Immunzell-(Unter)Gruppen ermittelt. Im Gegensatz dazu verfolgen wir einen innovativen Ansatz, der auf der Hypothese beruht, dass die Zusammenschau aller genannten Faktoren sich in der CLL intrinsischen Signalweg (De)-Regulation wiederspiegelt (Abbildung 2), welche wir durch die Kombination von CLL-Transkriptom- und Phosphoproteomdaten analysieren.
Des Weiteren modellieren wir die CLL-Heterogenität in vivo, indem wir verschiedene genetisch veränderte Mausmodelle auf einem Tcl-1 Transgenen (tg) Hintergrund verwenden (Abbildung 3).5 Das Tcl-1-Transgen ist dabei für die Ausbildung und Etablierung von CLL im Mausmodell verantwortlich, während die genetischen Defekte in bekannten Targets die Entwicklung der CLL bzw. die Therapieresistenz modulieren, indem sie die Abhängigkeit vom Mirkomilieu3 und/oder die Kommunikation von CLL-Zellen mit Immunzellen4 und schließlich das Muster der (De)Regulierung des intrinsischen CLL-Signalwegmusters verändern.
In unseren Untersuchungen verwenden wir das Tcl-1 transgene Mausmodell, welches eine murine CLL entwickeln, die der menschlichen Krankheit sehr ähnlich ist. Tcl1 transgenen Tieren werden mit genetisch veränderten Mäusen gekreuzt, welche entweder Defekte in der Apoptoseregulation (z.B. verschiedene Mitglieder der Bcl-2-Familie), in der Zellzyklusregulation (z.B. p21), in Signalwegen (z.B. BIRC3, Verlust der Ubiqutin-Ligase-Funktion) oder in der Immuninteraktionen (z.B. IRF4) aufweisen. Darüber hinaus sind Mausmodelle mit Defekten in der Cytokin-Signalübertragung geplant. Mit diesen verschiedenen Mausmodellen überwachen wir die CLL Entwicklung über Zeit, die Architektur der B-Zell-Rezeptoren (die als eine der wichtigsten Faktoren in der CLL Pathophysiologie gilt) und die Zusammensetzung bzw. den Differenzierungsstatus von Immunzellen. Dies geschieht sowohl in primären Modellen als auch in Folge einer Tumortransplantation in immunkompetente oder immundefiziente Empfängermäuse (Abbildung 3).
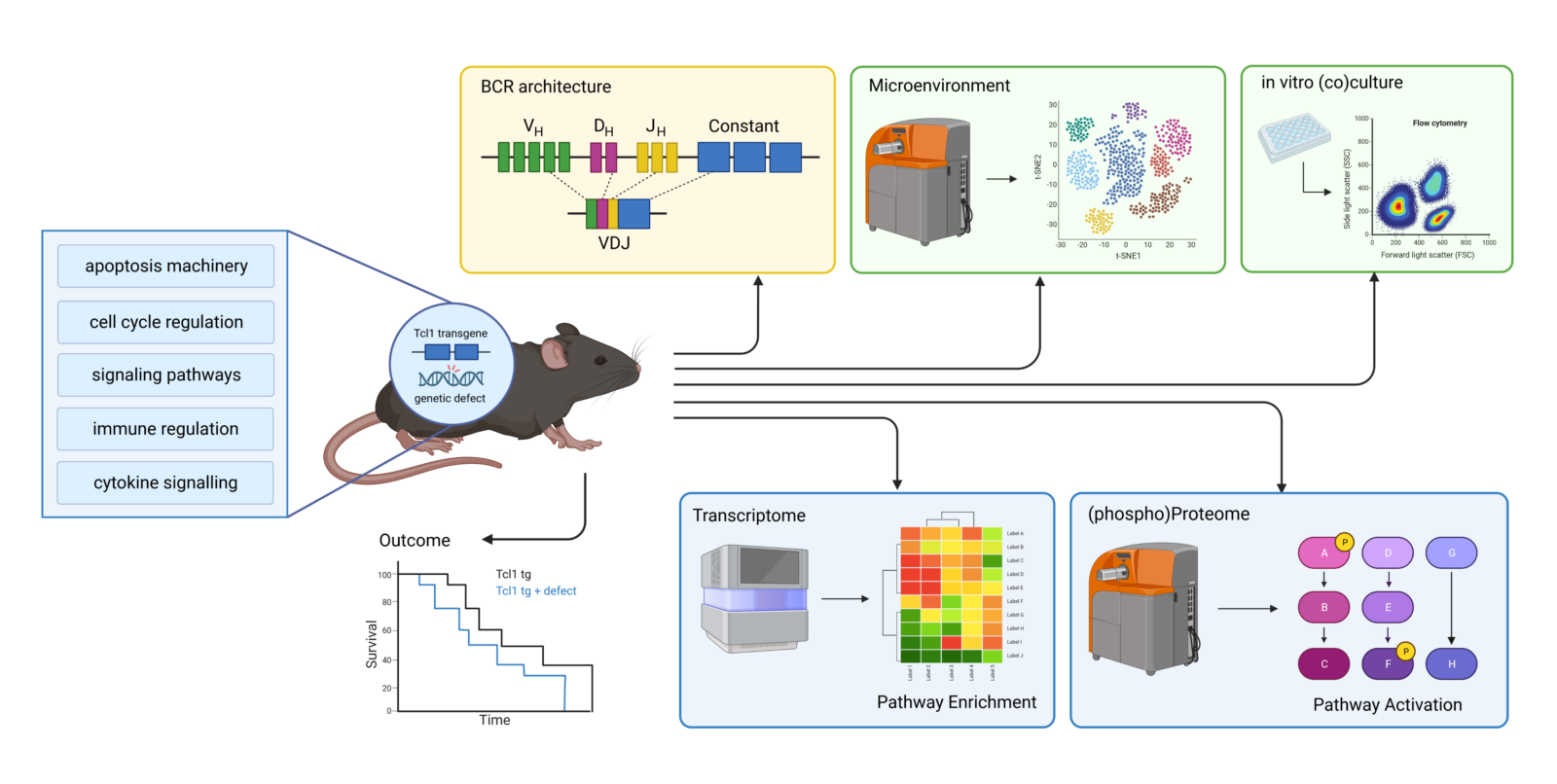
Die Überwachung der CLL Entwicklung und Progression in vivo ist von großer Bedeutung, da bekannt ist, dass CLL Tumorzellen das sie umgebende Mikromilieu entsprechend ihrer Bedürfnisse formen. Dadurch werden die Tumorzellen vor einer intrinsischen oder vom Empfänger induzierten Anti-Tumor-Immunantwort geschützt und gleichzeitig überlebensfördernde und/oder proliferationsfördernde Faktoren bereitgestellt, die das Tumorwachstum fördern. Darüber hinaus ermitteln wir die Empfindlichkeit von CLL-Zellen nach einer medikamentösen Behandlung oder nach einer Stimulation von CLL-Zellen in vitro. Das Transkriptom von CLL-Zellen (mit oder ohne Stimulation/Behandlung) wird mittels RNA-Seq und das (Phospho) Proteom mittels Einzelzell-Massenzytometrie und klassischen Methoden (z. B. Phospho-Flow) analysiert. Unser Ziel ist es, Daten aus diesen verschiedenen Quellen: Überlenszeit, B-Zell-Rezeptor-Architektur, Transkriptom, (Phospho) Proteom und in-vitro Stimulation/Behandlung bioinformatisch zu kombinieren und schließlich Signalwegmuster zu untersuchen, die für einen bestimmten genetischen Defekt spezifisch sind. Dies schließt die Wechselwirkung von verschiedenen Signalwegen und die CLL eigene Kompensation für verlorene oder hinzugewonnene Signale, sowie die Auswirkungen auf die Gestaltung des Mikromilieus, das Überlebens- und Wachstumspotential des Tumors und die Mechanismen zur Vermeidung von Immunangriffen mit ein.
Die Vorhersage des klinischen Verlaufs von CLL in Bezug auf die Prognose, den Behandlungserfolg und einen eventuellen Krankheitsrückfall ist eine Herausforderung, da eine Reihe verschiedener Parameter an der Pathogenese der CLL beteiligt sind. Dazu gehören nicht nur die genetischen Voraussetzungen (wie Mutationen oder Chromosomenaberrationen), sondern auch die Architektur des Mikromilieus und das Zusammenspiel mit anderen Immunzellen. Wie bereits erwähnt, formen CLL-Zellen ihr Mikromilieu so, dass sie Immunangriffen entweichen, indem sie die Differenzierung von Immunzellen (z. B. in erschöpfte T-Zell Untergruppen) vorantreiben. Außerdem stimulieren CLL Zellen umliegende Zellen des Mikromilieu dazu, überlebensfördernde und/oder proliferationsfördernde Faktoren bereitzustellen, die das Tumorwachstum begünstigen. Weiters können genetische Defekte die Veränderung des Mikromilieus erleichtern und/oder die Expression oder Funktion von Tumor relevanten Genen verändern (Abbildung 2). Die große Vielfalt an mutierten Genen und die Tatsache, dass dieselben Gene nur bei einem sehr geringen Prozentsatz der CLL-Patienten mutiert sind, lässt darauf schließen, dass diese Mutationen zwar offensichtlich die Pathogenese der CLL begünstigen, aber nicht zwingend erforderlich sind. Betrachtet man jedoch die Signalwege, so zeigt sich, dass die hohe Zahl der mutierten Gene mit einer sehr begrenzten Zahl betroffener Signalwege einhergeht. Daher stellen wir die Hypothese auf, dass das CLL Signalwegmuster von individuellen Patienten, welches ein kumulatives Signal aus der fehlgeleiteten Expression von Tumor relevanten Genen, entweder verusacht durch genetische Defekte oder Interaktionen mit dem Mikromilieu, darstellt, ein besserer Parameter für den klinischen Verlauf ist, als jede Einzelinformation allein. Um das Muster der Signalwege zu ermitteln, verwenden wir, ähnlich wie beim Mausmodell, eine Kombination von Informationen aus dem Transkriptom, dem (Phospho) Proteome und genetischen Aberrationen, die bioinformatisch zusammengeführt und mit Hilfe von Signalweg-Datenbanken analysiert werden. Abschießend, werden die klinischen Ergebnisse und die Ergebnisse der in vitro Stimulation/Behandlung integriert.
Team
Alexander Egle (PI)
ORCID: 0000-0003-0648-4416
Daniela Asslaber (PostDoc)
ORCID: 0000-0002-8711-016X
Jennifer Luise Forster (Dissertantin)
ORCID: 0009-0000-5247-0512
Wichtige Publikationen
Asslaber D, Qi Y, Maeding N, et al. B-cell-specific IRF4 deletion accelerates chronic lymphocytic leukemia development by enhanced tumor immune evasion. Blood. 2019;134(20):1717-1729.
Asslaber D, Wacht N, Leisch M, et al. BIRC3 Expression Predicts CLL Progression and Defines Treatment Sensitivity via Enhanced NF-kappaB Nuclear Translocation. Clin Cancer Res. 2019;25(6):1901-1912
Zaborsky N, Gassner FJ, Hopner JP, et al. Exome sequencing of the TCL1 mouse model for CLL reveals genetic heterogeneity and dynamics during disease development. Leukemia. 2018.
Egle A, Steurer M, Melchardt T, et al. Fludarabine and rituximab with escalating doses of lenalidomide followed by lenalidomide/rituximab maintenance in previously untreated chronic lymphocytic leukaemia (CLL): the REVLIRIT CLL-5 AGMT phase I/II study. Ann Hematol. 2018;97(10):1825-1839.
Kocher T, Asslaber D, Zaborsky N, et al. CD4+ T cells, but not non-classical monocytes, are dispensable for the development of chronic lymphocytic leukemia in the TCL1-tg murine model. Leukemia. 2016;30(6):1409-1413.
Greil R, Obrtlikova P, Smolej L, et al. Rituximab maintenance versus observation alone in patients with chronic lymphocytic leukaemia who respond to first-line or second-line rituximab-containing chemoimmunotherapy: final results of the AGMT CLL-8a Mabtenance randomised trial. Lancet Haematol. 2016;3(7):e317-329.
Lutzny G, Kocher T, Schmidt-Supprian M, et al. Protein kinase c-beta-dependent activation of NF-kappaB in stromal cells is indispensable for the survival of chronic lymphocytic leukemia B cells in vivo. Cancer Cell. 2013;23(1):77-92.
Asslaber D, Grossinger EM, Girbl T, et al. Mimicking the microenvironment in chronic lymphocytic leukaemia – where does the journey go? BrJHaematol. 2013;160(5):711-714.
Hofbauer JP, Heyder C, Denk U, et al. Development of CLL in the TCL1 transgenic mouse model is associated with severe skewing of the T-cell compartment homologous to human CLL. Leukemia. 2011;25(9):1452-1458.
Sie haben ein Anliegen oder Fragen?
Nehmen Sie mit uns Kontakt auf – wir melden uns umgehend bei Ihnen zurück.

